 更多“盐酸能导电的原因是溶液在电流作用下电离成自由移动的离子()”相关的问题
更多“盐酸能导电的原因是溶液在电流作用下电离成自由移动的离子()”相关的问题
A.氯化钾溶液在电流作用下电离出钾离子和氯离子
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属于弱电解质
D.纯净的强电解质在液态时,有的导电有的不导电
A.强电解质在溶液中完全电离,不存在电离平衡
B.强电解质溶液导电能力强,弱电解质溶液导电能力弱
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.电解质溶液的导电性强弱是由自由移动的浓度决定的
正极材料为LiCoO2的锂离子电池被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
问题一、橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是()。
②共沉淀反应的化学方程式为()。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能()。
问题二、废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过以下实验方法回收钴、锂 。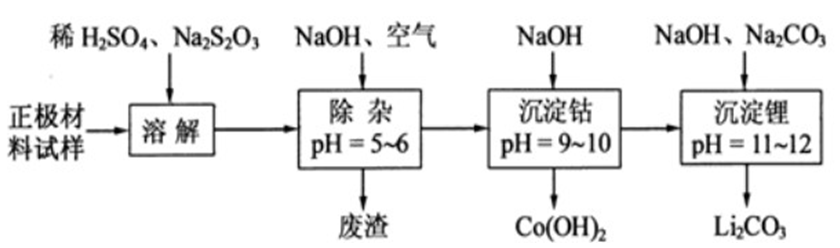
①在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的化学方程式为()。
②Co(OH)2在空气中加热时,固体残留率随温度的变化如以下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体成分为()。(填化学式);在350~400℃范围内,剩余固体成分为()。(填化学式) 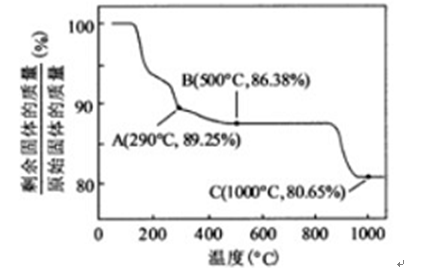
A.SO2的水溶液能导电说明SO2是电解质
B.HClO是弱酸,所以NaClO是弱电解质
C.某无色溶液加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则该溶液含有NH4+
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定存在大量CO32-
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑧
A.电子被阳极吸收,质子向阴极运动
B.负离子被阳极吸收,正离子向阴极运动
C.电子被阴极吸收,正离子向阳极运动
D.电子被阳极吸收,正离子向阴极运动


 如果结果不匹配,请
如果结果不匹配,请 

















